「新鮮な目」でとらえる新たな事象
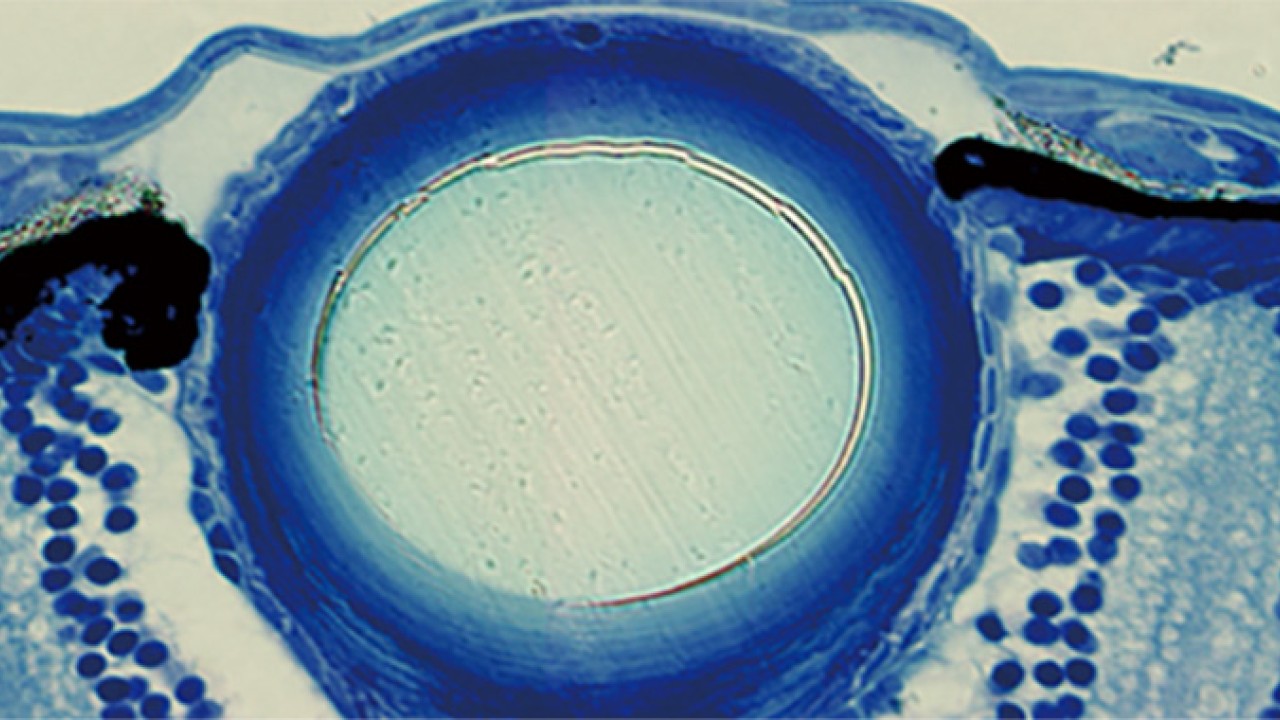
ヒトの目には数多くの組織があり、それらが連動して機能することで私たちはモノを見ることができます。脊椎動物の間では、眼の構造は驚くほどよく似ており、例えば、小型魚類のゼブラフィッシュとヒトの眼の構造においても大きな類似性が見られます。モノを見るのに必要な眼球の適切な大きさと形は、眼球組織の発達が正しく制御されることで保たれています。この緻密な発達制御の仕組みは、長年にわたり発生生物学者たちの注目を集めてきました。
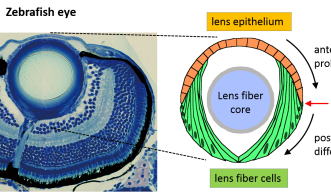
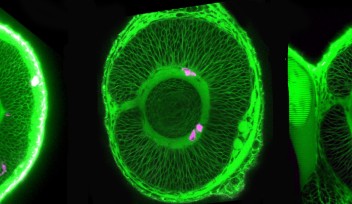
眼球の中には、水晶体と呼ばれる組織があります。水晶体は、取り込まれた光の焦点を網膜に合わせる役割を果たしています。網膜に送られた光は電気信号に変換され脳に伝わり、私たちはそれを視覚的に認識することができます。水晶体は、前面を覆う上皮細胞と、後部に集積する線維細胞で構成されています。水晶体前部の上皮細胞は、増殖しながら、水晶体後部へと移動し、前部と後部の境界である赤道部に到達すると線維細胞へと分化します。ここでは、この水晶体上皮細胞の移動のメカニズムを解明するために、沖縄科学技術大学院大学(OIST)において神経発生ユニットを率いる政井一郎准教授らは、タイムラプス画像解析技術を使ってゼブラフィッシュの水晶体が発生する過程をリアルタイムで観察しました。本研究結果は、英国の発生生物学専門誌Developmentにこのたび発表されました。
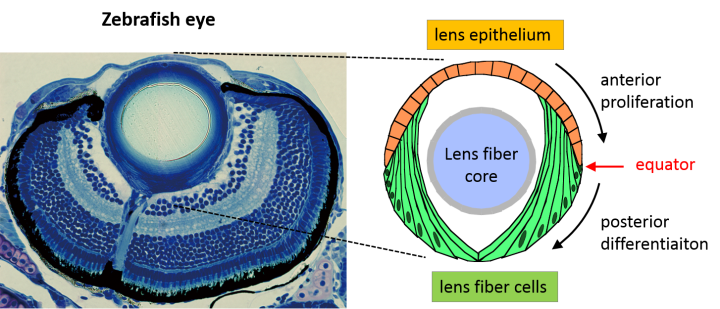
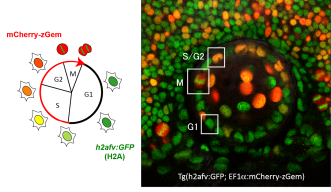
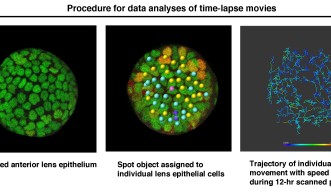
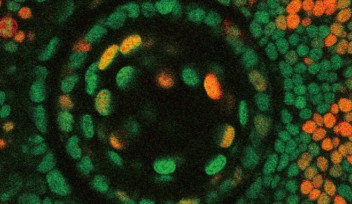
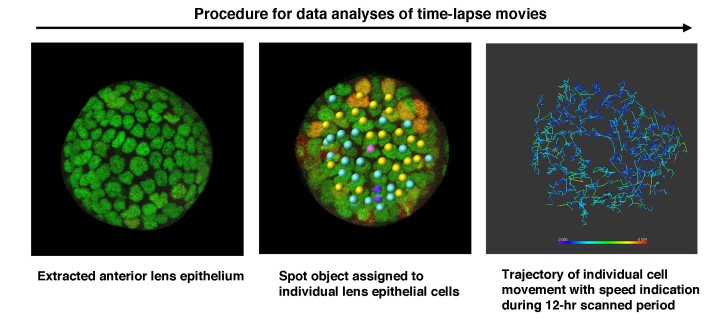
OISTの望月俊昭博士は、博士課程の学生であるイージュン・ルオさんとシェーフ・サイさんと共に、生きたゼブラフィッシュの胚を用いて、水晶体の上皮細胞が移動・発達する様子をリアルタイムで観察する手法を開発しました。ここでは遺伝子操作で作製した2種類の蛍光タンパク質を発現するトランスジェニックゼブラフィッシュを使いました。2種類の蛍光タンパク質の一つは、細胞周期制御因子であるGemininに赤色蛍光蛋白であるmCherryを融合したmCherry-zGem、もう一つは、ヒストンに緑色蛍光蛋白を融合したGFP-histoneで、それぞれ細胞周期の異なる時期に発現します。このトランスジェニックゼブラフィッシュでは、DNAの合成準備期であるG1期にはGFP-histoneのみが発現し、共焦点顕微鏡で見ると細胞は緑色をしています。DNA複製が始まるS期に入ると、mCherry-zGemが発現し、細胞の色は緑から黄色に変わります。さらにG2期では赤、M期には深紅色へと細胞周期が進むにつれ色が変化します。細胞周期から出て、活動休止状態のG0期にある細胞はmCherry-zGemタンパク質を発現せず、緑色となります。このように、細胞の蛍光蛋白の色を調べることで、個々の細胞の細胞周期の時期を正確に特定することが可能になりました。

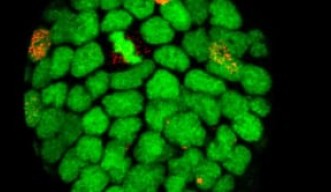
OISTの研究者らは、ゼブラフィッシュの水晶体発達過程のタイムラプス画像を分析し、水晶体上皮細胞が、細胞分裂を経験する細胞集団と非分裂細胞集団に分類されることを見つけました。タイムラプス観察の間、分裂経験細胞は細胞周期に伴い蛍光が変化し、一方、非分裂細胞では蛍光は変化せず、緑色を維持します。非分裂細胞は、お互いに接着してクラスターを形成して、隣接する細胞の分裂に伴って、クラスターを維持したまま、赤道部へ向かって水晶体上皮上を螺旋状に移動している様子が観察されました。この観察から、細胞分裂は、隣接する非分裂細胞が水晶体赤道部へ移動し、線維細胞へと分化するのを促進する可能性が示唆されました。また、実験結果から、水晶体上皮細胞の移動は、上皮細胞で発現するE-カドヘリンと線維細胞で発現するN-カドヘリンという2種類の接着タンパク質が関わる可能性が示されました。E-カドヘリンとN-カドヘリンは、それぞれ、水晶体上皮細胞の間で働く接着力と反発力を促進すると考えられます。この2つのカドヘリンは、水晶体上皮細胞の間の接着と張力を修飾することで、細胞移動を制御する役割を果たしています。
「私たちは、ゼブラフィッシュの水晶体上皮細胞を生きたまま長時間にわたって観察する手法の開発に成功しました」と、政井教授は語っています。「長時間のタイプラプス観察で、脊椎動物の水晶体上皮細胞の振る舞いを詳細に追跡するのはこれが初めての例だと思います。今回の研究で、眼の発生を制御する因子が判明し、それらが正常な発達に欠かせないものであることが明らかになりました」。