脳の情報伝達を調節する新しいメカニズムを発見
脳内の神経細胞間を電気信号となって情報が伝わるとき、様々な種類の分子が働いて情報伝達の機能を維持しています。OIST細胞分子シナプス機能ユニット(高橋智幸教授)のザカリ・タウフィック研究員と江口工学研究員はそれぞれの専門の生化学と電気生理学の手法を組み合わせ、Rhoキナーゼという酵素が神経細胞間の情報伝達を調節する重要な分子であることを発見しました。
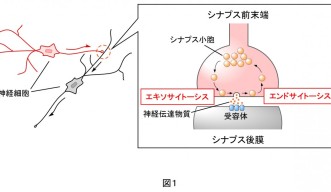
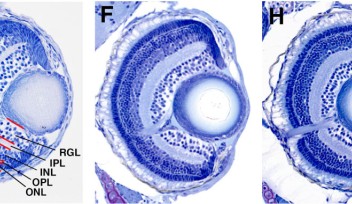
神経細胞間の接合部分に目を向けると、神経細胞から神経細胞へ神経伝達物質をやりとりするためのシナプスと呼ばれる部位が存在しています(図1)。伝達物質を放出する側をシナプス前末端、受け取る側をシナプス後膜といい、シナプス前末端には伝達物質を詰め込んだシナプス小胞と呼ばれる直径50ナノメートルほどの袋が格納されています。電気信号がシナプス前末端に到達すると、シナプス小胞が前末端膜に融合し、中の伝達物質を外へと放出します(エキソサイトーシス)。シナプス後膜は伝達物質を受容体で受け取り、電気信号へと変換し情報が受け渡されます。シナプス前末端膜に融合した小胞膜はその後末端内に取り込まれ(エンドサイトーシス)、再びシナプス小胞としてリサイクルされます。
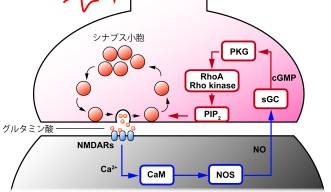
今回着目したのは、このエンドサイトーシスに関わる謎の分子でした。昨年の江口研究員の研究で、エンドサイトーシスがシナプス後膜から放出された一酸化窒素によって加速することや酵素のcGMP依存性プロテインキナーゼ(PKG)と脂質のホスファチジルイノシトール4,5-二リン酸(PIP2)が関与していることを特定していましたが、PKGとPIP2の間の反応をつなぐ分子は未発見のままでした(図2) (Eguchi et al., Neuron 2012)。江口研究員は「この分子を見つけるには、電気生理学の手法だけでは難しさを感じていた」と言います。そこに生化学を専門とするタウフィック研究員が加わったことで、研究は大きく前進しました。
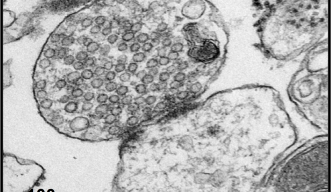
タウフィック研究員は多くの候補の中で最も有力だと考えられるRhoキナーゼをターゲットとして絞り込みました。ラットの脳試料からシナプスを含む細胞膜成分を取り出し(図3)、質量分析装置を使ってそこに含まれるPIP2分子の量を測りました。Rhoキナーゼの働きを抑える物質(阻害剤)を加えたときにPIP2が減り、活性化させる物質(活性剤)によってPIP2が増えることを確認しました。また、以前の報告でPKG阻害剤がPIP2を減らすことがわかっていましたが、Rhoキナーゼ活性剤がこの効果を打ち消すことも明らかとなりました。Rhoキナーゼが確かにPKGとPIP2をつなぐ物質であることを突き止めたのです。
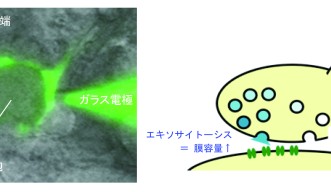
しかし、この反応がいつどこで起こっているのか、また神経伝達にどのように働いているのかは、この手法だけでははっきりしません。江口研究員はRhoキナーゼの働きを抑えたときと活性化したときとで、シナプス前末端で起きるエンドサイトーシスの速さに違いがあるかを、膜容量測定法と呼ばれる電気生理学的手法で調べました(図4)。その結果、抑制剤によってRhoキナーゼの働きを阻害するとエンドサイトーシスは遅くなることを確認しました。またPKG阻害剤によるエンドサイトーシスの減速は、Rhoキナーゼの活性剤によって打ち消されることもわかり、RhoキナーゼがPKGとPIP2の間の反応を仲介し、シナプス小胞膜のエンドサイトーシスを制御していることが明らかになりました。
高橋教授は生化学と電気生理学を併せて用いたことで揺るぎない結果が出せたことを強調し、「これほど詳細に詰めを行った研究はめったにない」と述べました。これまでの多くの研究は分子の存在がわかっても、その分子の振る舞いを時空間的に正しく説明できるものはあまりなかったと言います。今回の研究手法は、神経伝達の研究を分子と現象の関係を明らかにするレベルへ飛躍的に引き上げました。将来、パーキンソン病やアルツハイマー病などの神経伝達に関わる病気の理解や治療に役立つことが期待されます。
本研究の成果は、2013年7月17日付けのJournal of Neuroscienceに掲載されました。
専門分野
研究ユニット
広報・取材に関するお問い合わせ
報道関係者専用問い合わせフォーム