はじめから二量体構造をもつ細胞膜受容体
「BioEssays誌の表紙を飾ったローテーション・モデルが、従来の膜受容体に対する考え方を一変させるでしょう」と語るのは、約半世紀に渡りインスリンとインスリン受容体結合の研究を続けてきた著名な研究者、ピエール・デ・メイツ(Pierre De Meyts)教授です。デ・メイツ(De Meyts)教授は、沖縄科学技術大学院大学で情報処理生物学ユニットを率いる丸山一郎教授による論文の査読者の一人でもあります。
この度、丸山教授が提唱した受容体活性化の新モデル「ローテーション・モデル」は、膜貫通型の細胞表面受容体の研究100件以上をメタ分析した結果と、教授自身の研究に基づいて打ち立てられたものです。この理論が立証されれば、分子細胞生物学や生化学分野、医薬品業界等に大きな変化をもたらすと考えられています。
細胞内外の情報伝達機構
細胞内は、細胞膜により細胞外の環境から隔てられ、守られています。細胞外環境シグナルの正しい認識・処理が、生命体の生存と生殖に必須です。受容体は細胞膜に存在するタンパク質で、細胞内外の情報伝達を行う役割を担っています。
受容体は特定の分子にのみ反応します。このため、受容体には様々な種類が存在します。例えば、ヒトには受容体の遺伝子が1000個以上あります。しかし、各受容体において、その基本的な活性化メカニズムに違いは見られません。ホルモンや増殖因子、サイトカイン、栄養素など、これら特定の受容体に選択的に結合するリガンドと呼ばれる全ての物質は、受容体に結合すると細胞の代謝と活動に変化を引き起こします。
このリガンドと受容体との結合は、生命体のあらゆる機能に欠かせない重要な生体反応です。受容体の異常活性化が起きると、がんや発達障害、精神障害などを引き起こすことがあります。このため、新薬の開発・研究においてリガンドと受容体結合の仕組を理解することは極めて重要で、少ない服用量でも効果的で副作用が出にくい医薬品の開発にも繋がります。
医薬品は原則的に受容体と結合し、生体反応を引き起こします。医薬品は生体内のリガンドと同じように振る舞うことから、欠勤社員の肩代わりをするパート従業員に例えることができます。任務を果たせない従業員はお払い箱というわけです。
従来の「二量体化」モデル
従来の「二量体化モデル」では、リガンド結合前の受容体は単量体(モノマー)で存在すると考えられていました。単量体受容体がリガンドと結びつくことで、構造的に類似する2つの単量体が結びつき、二量体を形成するという主張です。
しかし、丸山教授はこの仮説に異論を唱えています。「もし受容体が単量体で存在するとしたら、それは細胞に害を及ぼすことになります」。動物細胞の細胞膜は、正常な体温では固体ではなく植物油のような液体に近い状態です。細胞膜を構成しているタンパク質やコレステロール、その他の物質は膜上を水平に移動することができます。そのため、リガンドがなくても、単量体の受容体同士が無作為に衝突して二量体を形成し、細胞の活性化を引き起こしてしまう可能性があるというのです。「しかし、自然というのはよく出来ていて、リガンド結合前の受容体は必ず不活性二量体で存在しているのです」と、丸山教授は説明します。これまでの研究でも、インスリン受容体などの受容体チロシンキナーゼや、成長ホルモン受容体のようなサイトカイン受容体など、多くの受容体は、リガンドがなくても初めから二量体で存在していることが分かっています。
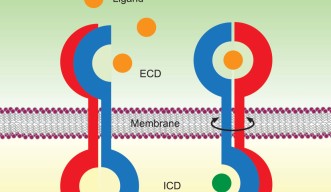
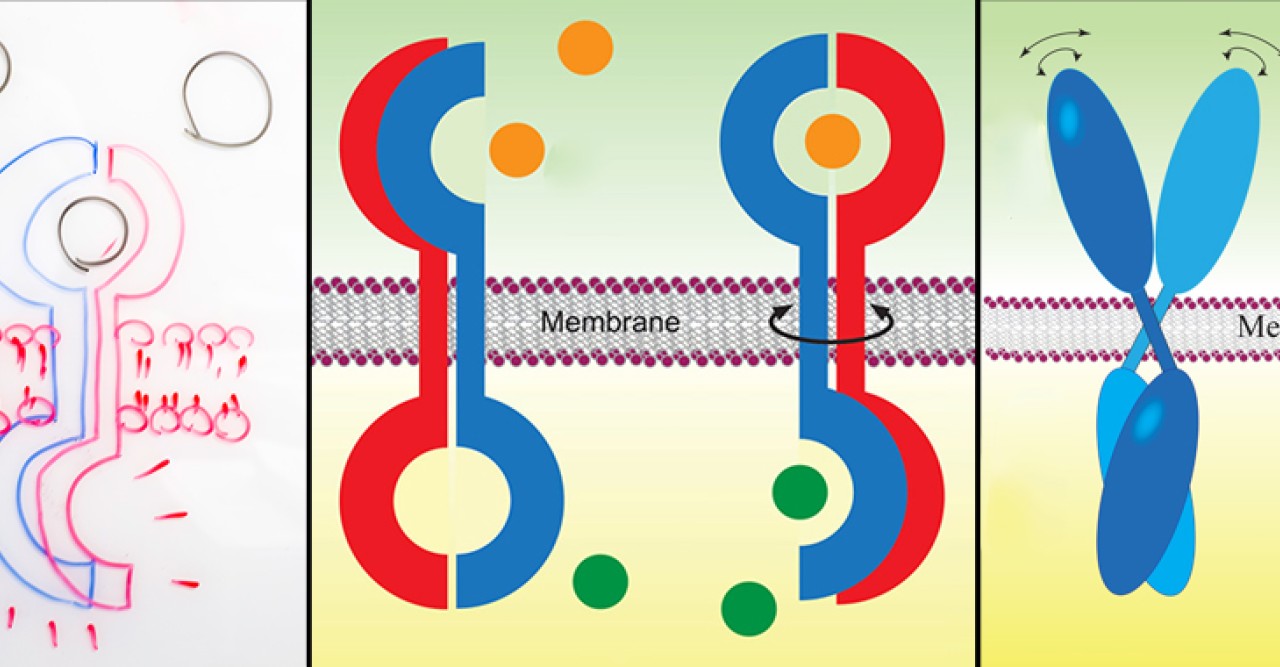
ローテーションモデル
丸山教授の「ローテーション・モデル」は、二量体型受容体のリガンドによる活性化の仕組みを説明しています。丸山教授は、細菌のアスパラギン酸受容体(Tar)やヒトの上皮成長因子受容体(EGFR)、ヒトの脳由来成長因子受容体(BDNFR)など、これまで盛んに研究が行われてきたいくつかの受容体活性化の研究をしてきました。その結果、受容体に特異的に結合するリガンドの有無に係らず、これら受容体は全て同様の二量体構造を有しているという結論に達しました。そして、受容体の活性化の際、受容体の膜貫通領域が、細胞膜に対して平行に回転することを発見しました。
受容体の細胞外部分にリガンドが結合すると、細胞膜内の膜貫通領域の回転を誘発し、細胞内の活性化を起こします。さらに、その過程においてタンパク質の柔軟性(フレッキシビリティー)も変化します。リガンド結合前は、受容体の細胞外部分の柔軟性が高く、細胞内部分は安定していますが、結合後はその逆で、外部分が安定化し、内部分の柔軟性が高まります。このようなタンパク質の柔軟性は生体内で作られる熱エネルギー、つまり体温により起こります。
丸山教授は、受容体の膜貫通領域の回転に要するエネルギーは「二量体化理論」が主張する流体膜中の単量体型受容体の並進運動に必要なエネルギーに比べて、小さくて済むと言います。自然界はエネルギー効率に優れた仕組みを選択する傾向があります。これは、丸山教授が打ち出した新モデルの妥当性を裏付ける根拠の一つと言えます。
デ・メイツ(De Meyts)教授は、「(二量体化)モデルが間違った理論であるという丸山教授の主張には説得力があります。細胞膜受容体の多くが膜中で既に二量体化していて、リガンド結合により受容体活性のアロステリック制御が起こるのです」と力説しています。