休止期の細胞が増殖能力を維持するための遺伝子を発見 -新たな癌治療に向けて-
概要
細胞は決まった周期で分裂と増殖を繰り返していますが、その周期から外れて休止している状態をG0(ジーゼロ)期といいます。筋肉、心臓、神経など、ヒト体細胞の90%以上はこれにあたります。沖縄科学技術大学院大学(OIST)G0細胞ユニット(代表:柳田充弘教授)の佐二木健一研究員らは、細胞が休止している期間においても再び増殖できる能力を維持するために必要な遺伝子群を発見し、その仕組みの一部を解明しました。この遺伝子群は3800以上の遺伝子の中のわずか85個に絞られ、その中には休止期の細胞内で活性化されるリサイクルシステム(「オートファジー」(注1)を含むシステム)から核を保護する機能が含まれていることがわかりました。
この研究成果は、生物にとって重要な仕組みの解明に道筋をつける他、再増殖能力を維持したまま休止期に留まることによって現行の治療に耐性を持つ癌幹細胞を標的とした新たな癌治療の開発にもつながる可能性があります。 本研究成果は、米国の科学誌Scienceの姉妹版電子ジャーナルScience Advancesに掲載されました。
研究の背景と経緯
生物の基本単位である細胞は、栄養状況が悪化するなど環境が増殖(成長)に適さなくなると、増殖能力は保ちつつも細胞分裂を停止する期間「G0(ジーゼロ)期」に入ります。この時、再び環境が良くなり活動を再開した際に、また増殖する能力「増殖能」を維持することは、生物にとって生死にも匹敵する重要な問題です。単細胞生物の場合、増殖能を失えば子孫を残せませんし、多数の細胞からなる高等生物にとっても代謝や発達に重大な影響を及ぼすからです。また、G0期での増殖能の維持は、癌治療の側面からも注目されています。近年、癌腫瘍の中には様々な種類の細胞が存在することが報告されていますが、中でも癌幹細胞と呼ばれる細胞はG0期に留まり、増殖細胞を標的とした現行の治療を逃れ、完治を困難にしています。
研究チームはこれまで、G0期で細胞が増殖能を維持する仕組みの解明を目指して研究を続けてきました。先行研究では、分裂酵母を用いた実験から、G0期での増殖能維持に必須な遺伝子81個を同定しました。これらの遺伝子群はG0期のみならず増殖期でも必須だったため、「スーパーハウスキーピング(SHK)遺伝子」と名付けました。今回、チームはG0期に特異的に必要な遺伝子群85個を新たに同定し、「G0エッセンシャル(GZE)遺伝子」と名付けました。さらに、SHK遺伝子群とGZE遺伝子群の関係性を象徴するような研究結果も確認できたことから、G0期で増殖能を維持する遺伝子ネットワーク全体の構造が明らかになってきました。
研究内容
分裂酵母は培地中の窒素源を除去することによりG0期に進入(注2)し、再添加により増殖期に戻ります。この性質を利用して、人為的にある特定の遺伝子を取り除いた(注3)3800株を超える分裂酵母を用意し、G0期に進入した後、増殖期に戻れない85株を選び出しました。それら85個の取り除かれていた遺伝子は、G0期の増殖能維持に特異的に必要であったため、「G0エッセンシャル (GZE)遺伝子群」と名付けました。
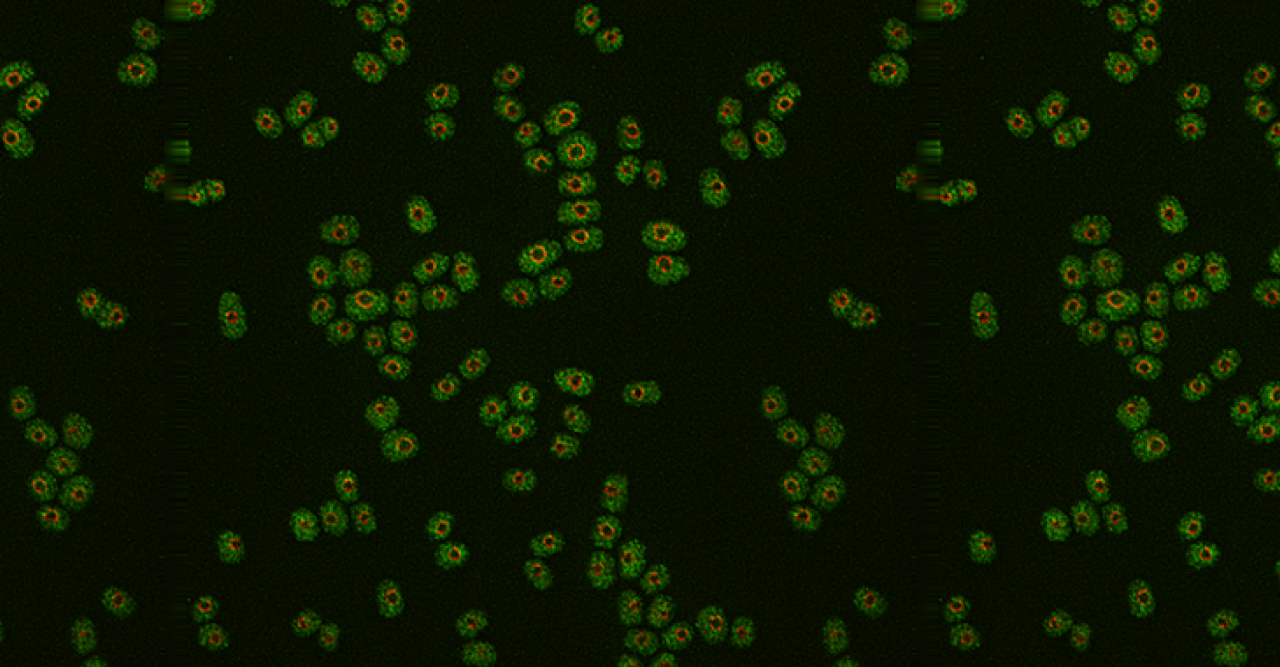
これらのGZE遺伝子群の中で、特にタンパク質の脱リン酸化(注4)に関わる酵素とオートファジー(自食)に関わる遺伝子の数が多く、中でも最も著しい増殖能低下を示したのは「Nem1脱リン酸化酵素」のない分裂酵母株でした。観察すると、この株は窒素源除去後、顕著な核の変形を起こしていました。さらに研究を進めると、核の変形は、オートファジー経路を阻害すると改善され、増殖能も回復することがわかりました。
さらに、Nem1酵素がリン酸化を行う標的タンパク質として「Ned1/lipin遺伝子」がありますが、この遺伝子は、以前の実験によってスーパーハウスキーピング(SHK)遺伝子として同定されていました。そこでNem1とNed1/lipinのG0期での関係を調べたところ、Ned1/lipinは窒素源除去後にNem1によって脱リン酸化されることがわかりました。また、人工的に変異を誘発させたNed1/lipinの変異株は Nem1のない株と同様の増殖能低下と核異常を示すことがわかり、さらに、これらの異常もオートファジー経路を阻害することで改善することがわかりました(図1)。
これらの結果は、Nem1-Ned1/lipin経路が正常に働き、オートファジーの過度な自食から核を保護することがG0期での増殖能維持に必須であることを示唆しています。また、ここでは、Nem1(GZE遺伝子)がスイッチとなり、Ned1/lipin(SHK遺伝子)を制御するという関係性も見えました。このことは、GZE遺伝子群とSHK遺伝子群がそれぞれG0期に特化したスイッチとそのスイッチに制御される基本的細胞機能を担う集団である可能性を示唆しており、増殖能を維持する遺伝子ネットワークの構造が垣間見える結果となりました。
今回の研究成果のインパクト・今後の展開
私たちの体のほとんどの細胞は成長も分裂もしない休止の状態であるG0期にあります。そのG0期で増殖能がどのように維持されているのかという問題を理解することは、私たちの生命活動にも深く関わり、今回の研究成果はその仕組みの全体像を提示しています。先に同定されたSHK遺伝子群と今回同定したGZE遺伝子群は、増殖能を維持する仕組みのフレームワークとなり得るものです。Nem1-Ned1/lipin経路とオートファジーの関係は核とリサイクルシステムの関係を示したものですが、同定された遺伝子群の中にはこの関係をさらに興味深くするものも含まれています。今後、これら遺伝子群の解析により仕組みがさらに明らかになることが期待されます。
また、G0期での増殖能を維持する仕組みは、近年報告されているG0期に留まる癌幹細胞を標的とした新たな癌治療につながる可能性もあります。実際、GZE遺伝子群の40%以上で癌との関連性が報告されています。「基礎研究の結果はなかなか特効薬にはなり得ませんが、対処療法とは違った根本的な解決につながるものだと考えています」と、佐二木博士は期待を持って語ります。
用語説明
注1 オートファジー:細胞内の自食作用。不要な物質を分解して廃棄したり、リサイクルしたりする。栄養豊富な状態では、オートファジーは抑制されているが、細胞が飢餓状態に陥ると、オートファジーが誘導される。
注2 G0期:分裂酵母は、窒素源を枯渇させた培養条件下ではG0期に誘導され、成長も分裂もせずに少なくとも二ヶ月以上の長期にわたって生存を維持する。再び、窒素源を添加すると増殖期に戻る。
注3 遺伝子破壊株:人工的に組換えを起こし、ある遺伝子を取り除いた株を遺伝子破壊株という。増殖期に必須な遺伝子は取り除けないため、作れるのは必然的に増殖期に不要な遺伝子の株のみとなる。
注4 脱リン酸化:細胞は、その機能を維持するために情報伝達を行っている。細胞内の情報伝達は、シグナルタンパク質がリン酸基を付けたり外したりして行う場合が多く、脱リン酸化はリン酸基を外すことを指す。リン酸基を外すのは、付ける場合に比べエネルギーが少なく済み、栄養源除去下でのG0期に特化したシグナル伝達(注5)がリン酸基を外すことで行われることは理にかなっている。
注5 シグナル伝達系:細胞内で情報を伝達する経路。シグナル伝達を担うタンパク質のリン酸基のやり取りで行われる例が多く報告されている。

広報・取材に関するお問い合わせ
報道関係者専用問い合わせフォーム