記憶の鍵となる受容体を働かせる仕組みを解明
(共同プレスリリース:京都大学、岐阜大学、OIST、iCeMS)
概要
京都大学大学院医学研究科 岡昌吾 教授、森瀬譲二 同助教、岐阜大学研究推進・社会連携機構 生命の鎖統合研究センター(G-CHAIN) 鈴木健一 教授、沖縄科学技術大学院大学 楠見明弘 教授(後者2人は、京都大学物質・細胞統合システム拠点(iCeMS=アイセムス)客員教授兼任)らの研究グループは、脳の記憶と学習に重要な働きをするタンパク質分子であるAMPA型グルタミン酸受容体が働くときに、どのように分子が組み立てられて働くのかを解明しました。
この受容体は、神経細胞同士の連絡を担うシナプスという部分で働きます。受容体は4つのパーツからできており、細胞は各パーツを4種から選ぶことができるので、用途に応じて最大256種の組合せが可能です。従来この分子組立は細胞内で起こり、違う用途の受容体を作るには新たな合成が必要だという不便な仕組みがあるものと信じられていました。
本研究で、本研究グループはその定説を覆しました。受容体の4つのパーツは0.1秒ほどでバラバラになり、それらがまたすぐに違うパーツと集まって4個で受容体を作って0.1秒間働き、またすぐにバラバラになるということを繰り返す、という驚くべき仕組みで働いていることが分かったのです。この仕組みを使うことで、神経細胞は環境変化や刺激に応じて、ただちに適した受容体をシナプスで作ることができるのです。また、4つのパーツに分けて運ぶことでシナプスに受容体を集めるのも素早くなることが分かりました。このような新事実の解明には、分子を1個ずつの分解能で観察して追跡するという新たな手法(1蛍光分子イメージング法)によって可能になりました。
AMPA型グルタミン酸受容体はてんかん発作の原因分子としても知られ、受容体のチャネル活性を制御する拮抗剤も治療薬として注目されています。本成果により、学習記憶の分子機構の理解や、関連する疾患への新たな治療薬の開発につながることが期待されます。
本研究成果は、2019年11月20日に、国際学術誌「Nature Communications」にオンライン掲載されました。
1.背景
私たちの脳はたくさんの神経細胞が結びついた神経回路網によってできています。神経細胞と神経細胞の結び目にはシナプスと呼ばれる場所があり、シナプスの前側の神経細胞からは神経伝達物質が放出され、シナプスの後側の神経細胞には神経伝達物質に対する受容体が存在して信号の受け渡しが行われます。シナプスは一旦形成された後も環境因子や学習などの神経活動によって変化することが知られており、シナプス可塑性*1と呼ばれる柔軟性を持っています。このようなシナプスにおける可塑性の分子機構を明らかにすることは学習記憶の分子基盤を理解するためにも、またシナプスに病変がある様々な神経疾患の病態解明にも、とても重要な研究課題です。
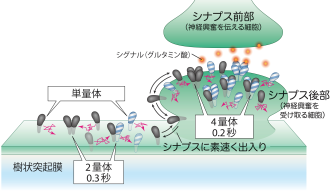
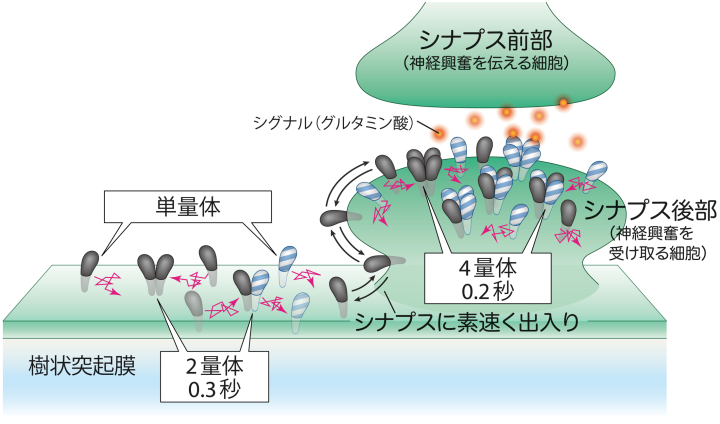
AMPA型グルタミン酸受容体*2は4つのサブユニット*3 (GluA1-4)から成り、四量体*4で機能するイオンチャネル*5型受容体で脳内の興奮性シナプスの可塑性に特に重要な分子です。神経活動に応じてAMPA型グルタミン酸受容体は、シナプス後部での数やサブユニットの組み合わせ*6が変化し、シナプスでの伝達効率が変化すると考えられています。AMPA受容体はシナプス後部で働きますが、その主要な供給源はシナプス領域外の樹状突起膜*7であるといわれています。従って神経活動に対応した樹状突起膜からシナプス後部へのすばやい移動が必要となります。これまでAMPA受容体は小胞体*8内で四量体が構築された後、細胞膜へ運ばれても依然安定な四量体として移動すると考えられてきました(図1左)。
しかし、この定説には無理な点がいくつもあります。AMPA受容体は四量体の形では神経細胞膜上をほとんど動かないという報告があります。また、神経活動に伴ってサブユニットの組成が違う受容体がシナプスに出現しますが、四量体が安定だと、不要な受容体をシナプスから追い出し、全く新しい組合せの四量体を合成してシナプスまで運ぶ必要があります。これには、多大な時間とエネルギーや原材料などのリソースが必要です。つまり組成の違う受容体に取り替えるのが非常に難しいのです。
一方私たちは以前、ゴルジ体*9での糖鎖修飾*10がAMPA受容体の四量体構成を大きく変えることを見いだしていました。糖鎖修飾は小胞体よりあとに行われるタンパク質修飾であるため、小胞体内で完成された安定な四量体の構成が、ゴルジ体で変化するというのは、以前からの定説が間違っている可能性を示唆していました。
2.研究手法・成果
それでは本当に細胞膜上のAMPA受容体は四量体として存在するのでしょうか?本研究ではその可視化に取り組むために、我々が開発してきた最先端の1蛍光分子イメージング法*11を改善して応用し、AMPA受容体サブユニットの1分子観察を行いました。この方法は、生細胞膜に存在する目的の1分子すべてをリアルタイムに観察できる手法で、分子の移動や結合状態を可視化することができます。
まず最初に、AMPA受容体をもたないHEK293細胞*12膜上で、蛍光標識AMPA受容体を観察しました。この条件では、すべてのAMPA受容体に蛍光の目印が付いているので、すべてのAMPA受容体分子を見ることが可能です。すると、四量体以外にも、単量体がたくさん見つかりました。加えてその四量体も安定的ではなく、単量体が集まっては一過的に四量体を形成し、0.1~0.2秒後には再び単量体・二量体・三量体へ分かれていく様子が極めて明瞭に見えました(図1右)。このように四量体は寿命が0.1~0.2秒しかないのですが、その間にイオンチャネルとして働くことも分かりました。
神経細胞でも、蛍光標識AMPA受容体を観察しました。神経細胞にはもともと多くのAMPA受容体があり、それらは蛍光標識できないので、単量体か四量体かを直接見定めることは不可能です。しかし、膜上を拡散運動する速さを測定することにより、樹状突起膜上では、多くが単量体(または一部二量体)として高速で動いてシナプス内に入り込むこと、また、シナプスから出ていくときも単量体として素早く出ていくことが分かりました。
シナプス内では、多数のAMPA受容体のサブユニットが濃縮されています。それで、単量体はすぐに四量体となりますが、四量体の寿命は0.1~0.2秒なので、すぐに分解します。四量体が分解する速度は決まっているものの、サブユニット濃度が高いと単量体同士がぶつかる機会が増え、単量体ができるとすぐに四量体となるため、各サブユニット分子は、シナプス内では、四量体として過ごす時間が増えます。ただ、あくまでも、1個の四量体の寿命は0.1~0.2秒程度である可能性が高いことに注意してください。この四量体が、チャネルとして機能します。
以上の結果から、神経刺激後にシナプス内でのサブユニット組成を変える仕組みとしては、必要なサブユニットが選択的に単量体としてシナプスに拡散運動で入ってくるというモデルが想定できます(図2)。すなわち、樹状突起のAMPA受容体は環境に応じて単量体の形ですばやくシナプス内に送り込まれ、そこで適切な四量体が作られては壊されているのです。本研究ではこのように、AMPA受容体は単量体として存在することによって、シナプス内で非常に効率良く形成・分解するモデルを提案することができました。

3.波及効果、今後の予定
AMPA受容体は四量体の形でイオンチャネルとして働きますが、それが細胞膜で作られては壊される事実は、チャネル機能を人工的に制御する方策を示唆するものです。例えば、AMPA受容体が起因で生じる神経細胞の過剰興奮は、てんかん発作を引き起こすことが知られます。その治療では、AMPA受容体に選択的に結合しチャネル機能を抑制する化合物(ペランパネル)が薬剤として使用されています。本研究は、チャネル自体を阻害してしまうのではなく、四量体形成の速度を微妙に抑えることで過剰興奮を適度に抑制するような、新たな作用点を持つ治療薬開発の可能性を示すものです。今後は本研究で見出したモデルを元に、神経興奮時にはAMPA受容体がどのように作られては壊されているのか、そのメカニズムをより詳細に調べつつ、治療薬開発へつながるような研究をしたいと考えています。
4.研究プロジェクトについて
本研究は、科学研究費補助金17K15090, 19K16074, 15H04351, 18H02401, 19H03370, 16K14695, 17K19521, 24247029, 16H06386、新学術領域23110006, 23110001, 18H04671、CREST[生命動態の理解と制御のための基盤技術の創出]、WPI-iCeMSの支援を受けて実施しました。
<用語解説>
*1シナプス可塑性:シナプスにおける情報伝達効率が刺激などにより長期間変化する現象
*2 AMPA型グルタミン酸受容体:神経伝達物質のグルタミン酸に結合する受容体の一つで、ナトリウムイオンを通過させるイオンチャネル型受容体。
*3サブユニット:1つの機能タンパク質が複数のポリペプチド(構成タンパク質)によって作られている場合、その構成タンパク質をサブユニットという。
*4四量体:分子4個が会合することでできる4分子複合体。
*5イオンチャネル:細胞膜に穴を作り細胞内外のイオンを通過させるチャネル。
*6サブユニットの組み合わせ:AMPA受容体は1種類のサブユニットから成る四量体(ホモ四量体)や、複数種から成る四量体(ヘテロ四量体)で構成される。神経細胞活動時には、その環境に適したホモまたはヘテロ四量体の存在がシナプス内に求められる。
*7樹状突起膜:神経細胞から枝のように伸びている突起の膜で、本研究では特にシナプス以外の場所を指す。
*8小胞体:分泌タンパク質や膜タンパク質が作られる細胞小器官。
*9ゴルジ体:小胞体で作られたタンパク質に様々な修飾を行う細胞小器官
*10糖鎖修飾:糖鎖がタンパク質に付加されること。分泌タンパク質や膜タンパク質の多くは糖鎖修飾を受ける。ゴルジ体と呼ばれる細胞内小器官で様々な糖鎖修飾が行われる。
*111蛍光分子観察と追跡:生細胞の中で観察したい目的分子に蛍光を発する分子を結合させ、蛍光を目印に1分子分解能でその分子を観察する方法。
*12 HEK293細胞:ヒト胎児腎細胞293。AMPA受容体の機能解析時に頻用される。

<研究者のコメント>
AMPA受容体は細胞膜上に四量体の形で存在すると言われていたので、初めて実験した際に単量体がたくさん見つかったときの興奮は今でも覚えています。このとき私の脳内のAMPA受容体たちが慌ただしく作られては壊されていたのかと考えると、面白いですね。結果のとりまとめに数年かかりましたが、無事成果として発表できて嬉しく思います。